réservé à la recherche
Rivaroxaban Factor Xa inhibiteur
N° Cat.S3002
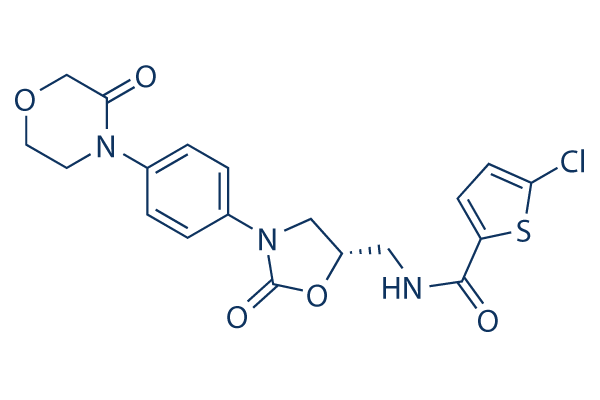
Structure chimique
Poids moléculaire: 435.88
Contrôle qualité
| Cibles apparentées | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase PPAR Vitamin Carbohydrate Metabolism Mitochondrial Metabolism |
|---|---|
| Autre Factor Xa Inhibiteurs | Asundexian |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 435.88 | Formule | C19H18ClN3O5S |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 366789-02-8 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | BAY 59-7939 | Smiles | C1COCC(=O)N1C2=CC=C(C=C2)N3CC(OC3=O)CNC(=O)C4=CC=C(S4)Cl | ||
Solubilité
|
In vitro |
DMSO
: 87 mg/mL
(199.59 mM)
Water : Insoluble Ethanol : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
Factor Xa
(Cell-free assay) 0.7 nM
Prothrombinase
(Cell-free assay) 2.1 nM
|
|---|---|
| In vitro |
Le Rivaroxaban est un inhibiteur oral direct du Factor Xa (FXa), en cours de développement pour la prévention et le traitement de la thrombose artérielle et veineuse avec un Ki de 0,4 nM. Ce composé inhibe également l'activité de la prothrombinase avec un IC50 de 2,1 nM. Il présente également une affinité similaire pour le FXa humain et de lapin purifié (IC50 de 0,7 nM et 0,8 nM, respectivement), mais une puissance moindre contre le FXa de rat purifié (IC50 de 3,4 nM). Le FXa humain et de lapin endogène dans le plasma est inhibé de manière similaire par cette substance chimique (IC50 de 21 nM et 21 nM, respectivement), tandis que des concentrations 14 fois plus élevées sont requises dans le plasma de rat (IC50 de 290 nM). Il présente une perméabilité élevée et un transport polarisé à travers les cellules Caco-2 en tant que substrat de la P-gp, mais ne présente aucun effet inhibiteur sur le transport de médicaments médié par la P-gp jusqu'à des concentrations de 100 μM in vitro.
|
| Kinase Assay |
Factor Xa Activity
|
|
L'activité du Rivaroxaban contre les sérine protéases purifiées est mesurée à l'aide de substrats chromogéniques ou fluorogéniques dans des microplaques à 96 puits. Les enzymes sont incubées avec ce composé ou son solvant, le diméthylsulfoxyde (DMSO), pendant 10 minutes. Les réactions sont initiées par l'ajout du substrat, et la couleur ou la fluorescence est surveillée en continu à 405 nm à l'aide d'un lecteur Spectra Rainbow Thermo, ou à 630/465 nm à l'aide d'un SPECTRAfluor plus, respectivement, pendant 20 minutes. L'activité enzymatique est analysée dans les tampons suivants (concentrations finales) : FXa humain (0,5 nM), FXa de lapin (2 nM), FXa de rat (10 nM), ou urokinase (4 nM) dans un tampon Tris-HCl 50 mM pH 8.3, 150 mM NaCl, et 0,1% d'albumine sérique bovine (BSA) ; Pefachrome FXa (50-800 μM) ou chromozym U (250 μM) avec de la thrombine (0,69 nM), de la trypsine (2,2 nM), ou de la plasmine (3,2 nM) dans 0,1 μM Tris-HCl, pH 8.0, et 20 mM CaCl2 ; chromozym TH (200 μM), chromozym plasmine (500 μM), ou chromozym trypsine (500 μM) avec FXIa (1 nM) ou APC (10 nM) dans un tampon phosphate 50 mM, pH 7.4, 150 mM NaCl ; et S 2366 (150 ou 500 μM) avec FVIIa (1 nM) et facteur tissulaire (3 nM) dans un tampon Tris-HCl 50 mM, pH 8.0, 100 mM NaCl, 5 mM CaCl2 et 0,3% BSA, H-D-Phe-Pro-Arg-6-amino-1-naphtalène-benzylsulfonamide-H2O (100 μM) et mesurée pendant 3 heures. L'essai FIXaβ/FX, comprenant FIXaβ (8,8 nM) et FX (9,5 nM) dans un tampon Tris-HCl 50 mM, pH 7.4, 100 mM NaCl, 5 mM CaCl2 et 0,1% BSA, est démarré par l'ajout de I-1100 (50 μM), et mesuré pendant 60 minutes. La constante d'inhibition (Ki) contre le FXa est calculée selon l'équation de Cheng-Prusoff. L'IC50 est la quantité d'inhibiteur requise pour diminuer de 50% la vitesse initiale du contrôle.
|
|
| In vivo |
Le Rivaroxaban réduit la thrombose veineuse de manière dose-dépendante (ED50 0,1 mg/kg i.v.) dans un modèle de stase veineuse chez le rat. Ce composé réduit la formation de thrombus artériel dans un shunt artério-veineux (AV) chez les rats (ED50 5,0 mg/kg p.o.) et les lapins (ED50 0,6 mg/kg p.o.). La pharmacocinétique plasmatique de cette substance chimique est linéaire sur la plage de doses étudiées (1-10 mg/kg chez les rats, 0,3-3 mg/kg chez les chiens). La clairance plasmatique est faible : 0,4 L/kg/h chez les rats et 0,3 L/kg/h chez les chiens ; le volume de distribution (V(ss)) est modéré : 0,3 L/kg chez les rats et 0,4 L/kg chez les chiens. La demi-vie d'élimination après administration orale est courte chez les deux espèces (0,9-2,3 heures).
|
Références |
|
Informations sur lessai clinique
(données de https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Sponsor/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT06193863 | Not yet recruiting | Prevention of Venous Thromboembolism|Congenital Heart Disease|Fontan Procedure|Children |
Bayer|Janssen Research & Development LLC |
May 31 2024 | -- |
| NCT06195540 | Not yet recruiting | Venous Thromboembolism|Deep Vein Thrombosis|Pulmonary Embolism|Lower Limb Trauma|Thromboprophylaxis|Immobilisation |
University Hospital Angers |
May 31 2024 | Phase 3 |
| NCT06314763 | Completed | Drug Drug Interaction Study |
Radboud University Medical Center|Amgen |
November 9 2023 | Phase 4 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
